|
|
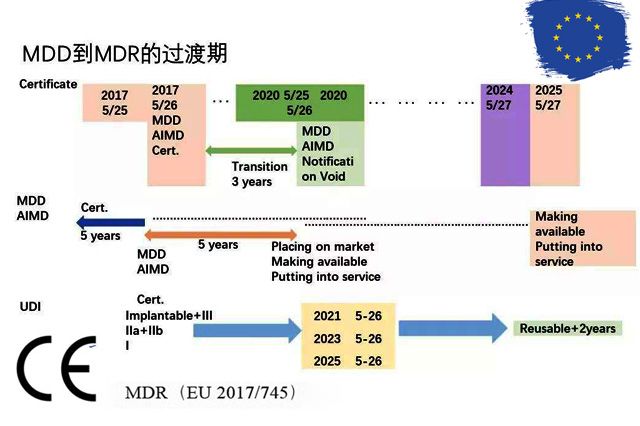
MDR何时生效?2017年5月5日,欧盟官方正式发布了欧盟医疗器械法规(MDR)。2017年5月25日,MDR正式生效。 医疗器械指令MDD(93/42/EEC)和有源植入类医疗器械指令AIMDDEEC)被医疗器械法规MDR(EU取代,法规过渡期为3年。 制造商应在过渡期内更新技术文件和流程以满足法规要求。具体可以参阅法规Article
1.在过渡期按照MDD和AIMDD签发的CE证书,在正式生效日期(2020年5月26日)后将继续有效,但有效期最多不能超过4年。而在过渡期结束后的证书有效性取决于法规Article 120 clause 3所述规定。 如果您符合MDD的CE证书在过渡期内失效,且又未在过渡期内取得符合MDR的CE证书。那么你的产品必须从欧盟市场退出,直到产品获得符合MDR的CE证书才可重新上市。
2.公告机构何时开始按照MDR进行符合性评审? 所有公告机构需要获得欧盟主管当局的认可后,才能按照MDR进行审核。目前公告机构BSI、TUV南德、TUV莱茵等公告机构,陆续开始受理MDR的申请。 我司可供英国、荷兰、德国欧盟授权代表,资质法规咨询专家可以协助企业编制CE技术文件,调整和变更技术文件内容,确保满足MDR的要求,编制器械第四版临床评估报告等 I366 -I555 -246
2.新MDR对分包方(contract manufacturers)有什么影响? 如果分包方要为他们所服务的制造商承担责任,那么他们必须全面遵守法规要求。 如果分包方不需要为他们所服务的制造商承担责任,那么他们仅需代表制造商接受审核,包括飞行检查。
3.MDR CE认证涵盖哪些产品?MDR包含了MDD及AIMDD涵盖的所有产品。新法规扩大了应用范围,覆盖一些非医疗用途的产品,如美瞳、面部填充或注射、吸脂减肥、皮肤改善和美容等产品。具体可参阅MDR中的Annex XVI。
4.产品分类是否有变化?MDR对于产品的分类规则有一些变化,应用范围比MDD和AIMDD的范围更广。具体可参阅MDR中的Annex VIII。
5.IIb类植入式医疗器械的符合性评估程序是否有变化IIb类植入式医疗器械需要有特定产品证书(product specific certificates)——具体内容可参见医疗器械法规MDR Annex IX或Annex X 。此证书上需要显示产品的UDI。此类产品在欧盟上市前,如证书信息有变更,必须通过公告机构的审核。
6.IIb类植入式医疗器械的技术文档评估可以按照通用产品组中抽样原则进行嘛?MDR CE认证指出IIb类植入式医疗器械需要通过详细的技术文档审核,类似于MDD中III类产品的技术文件要求。因此抽样的方案是不可行的。
7.III类产品的5年换证审核是由欧盟委员会审核,还是由发证的公告机构审核? 如果产品没有实质性的变化,5年的换证审核不需要由欧盟委员会审核。如产品有重大变更,则需要欧盟委员会的介入。
8.MDR涵盖的产品是否可以申请自我声明?MDR中对于I类(非测量、非灭菌、非重复使用的产品)可以使用自我声明。例如:灭菌压舌板、灭菌棉签、峰速仪 一类带测量等
9.对于I类可重复使用的产品,需要提供什么样的文件以证明产品的清洁? 除了产品的清洁说明书和相关确认文件,公告机构的审核还包括其他方面,如消毒、灭菌、保养和功能测试。
10.定期安全性更新报告(PSUR)是否会纳入临床评价报告(CER)?MDR要求临床评价需要根据上市后监督(PMS)的数据定期更新。但是,将定期安全性更新报告(PSUR)纳入临床评价报告(CER)并非强制。应使用定期安全性更新报告(PSUR)所基于的上市后监督(PMS)数据来更新临床评价报告(CER)。
 |
|